MindMap Gallery Mind map of water (H2O)
- 124
Mind map of water (H2O)
This mind map clearly shows various aspects of water (H2O), including pH, equilibrium constants, etc. Each topic is further divided into multiple levels, such as substance, body fluids, etc. It mimics the human brain structure, aiding in memory and information organization.
Edited at 2023-09-16 05:43:25- Recommended to you
- Outline
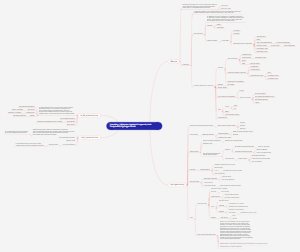
Agua (H20)
La molécula del agua, también conocida como H2O, es de vital importancia para la vida en la Tierra. Esta molécula está compuesta por dos átomos de hidrógeno y uno de oxígeno, unidos mediante enlaces covalentes. A primera vista, puede parecer una molécula sencilla, pero sus propiedades y comportamiento son realmente fascinantes. Una de las características más destacables del agua es su capacidad para disolver muchas sustancias. Esto se debe a su polaridad, ya que el oxígeno atrae más fuertemente a los electrones compartidos que los hidrógenos, generando una carga parcial negativa en el oxígeno y una carga parcial positiva en los hidrógenos. Esta polaridad permite que el agua forme enlaces con otras moléculas polares o iónicas, facilitando su disolución. Gracias a esto, el agua es un solvente universal esencial para reacciones químicas y procesos biológicos. Asimismo, la molécula del agua también tiene la capacidad de formar puentes de hidrógeno entre sus moléculas. Estos puentes son enlaces débiles que se dan entre la carga negativa de un oxígeno y la carga positiva de uno de los hidrógenos de otra molécula de agua. Estos puentes de hidrógeno le confieren al agua propiedades únicas, como su alta tensión superficial, su elevado punto de ebullición y su capacidad para moderar la temperatura de los organismos vivos. Además de estas características, la molécula del agua también es conocida por su elevada capacidad calorífica, lo que significa que requiere de una gran cantidad de energía para cambiar su temperatura. Este hecho es fundamental para regular la temperatura de la Tierra, ya que el agua de los océanos y los cuerpos de agua actúa como un sumidero térmico, absorbiendo calor del sol durante el día y liberándolo lentamente durante la noche, estabilizando así la temperatura y manteniendo las condiciones necesarias para la vida. En resumen, la molécula del agua es esencial para la vida tal como la conocemos. Sus propiedades únicas, como su capacidad para disolver sustancias, la formación de puentes de hidrógeno y su capacidad calorífica, son indispensables para el funcionamiento de los seres vivos y para mantener el equilibrio del planeta. Sin lugar a dudas, la molécula del agua es una de las maravillas de la química y de la naturaleza.
El agua es una sustancia que se compone por dos átomos de hidrógeno y un átomo de oxígeno (H2O).
La estructura de la molécula de agua forma un tetraedo irregular.
El ángulo entré los enlaces H-O-H es de 104.5°.
La electronegatividad del Oxígeno es mayor que la del Hidrógeno por lo que los electrones compartidos se desplazan hacia el Oxígeno y el Hidrógeno queda como positivo ( por qué dono su carga negativo).
Es una molécula dipolar ya que posee una región electropositiva y una región electronegativa
Puentes de hidrógeno
El átomo de hidrógeno de una molécula de agua es atraído hacia el átomo de oxígeno de otra molécula de agua debido a la diferencia de electricidad en los polos, formando un puente de hidrógeno.
son más débiles que los enlaces covalentes.
Pueden formar hasta 4 puentes de Hidrógeno.
confieren al agua sus propiedades únicas, como su alta tensión superficial, su capacidad de disolver muchas sustancias y su alta capacidad calorífica.
El agua en el organismo
Se encuentra fuera y dentro de las células, sangre y vasos linfáticos
El agua es fundamental para el funcionamiento del organismo y desempeña varios roles:
Hidratación: El agua es crucial para mantener el equilibrio de fluidos en el cuerpo y prevenir la deshidratación.
Transporte de nutrientes: Actúa como medio de transporte para llevar nutrientes y oxígeno a las células y eliminar productos de deseo.
Regulación de la temperatura: Ayuda a regular la temperatura corporal a través del sudor y la evaporación.
Participación en reacciones químicas: Es un componente en muchas reacciones químicas y procesos metabólicos del cuerpo.
Eliminación de desechos: Ayuda a eliminar toxinas y desechos a través de la orina.
Apoyo a la digestión: El agua es esencial para la digestión y absorción de alimentos en el tracto gastrointestinal.
Es el disolvente universal de soluciones iónicas y moleculares también es el componente estructural de todos los tejidos corporales.
Mecanismo de tamponamiento en el organismo
Amortiguadores de los líquidos corporales
Amortiguador bicarbonato
si se concentra la cantidad de H± se unia el Bicarbonato formado ácido carbónico.
Se disocia en CO2 y Agua por la enzima anidraza y se elimina en el pulmón.
Ocurre de inmediato
Regulación respiratoria
El C02 que entra por el intercambio de gases se combina con el agua por medio de la anidraza carbónica.
Forma Ácido Carbónico
El cual se va a disocia en bicarbonato y el hidrogenio que determina el pH.
La ecuación de Henderson-Hasselbalch
Bicarbonato es directamente proporcional al pH
cuando mayor es la PCO2 es mayor el CO2
Mas hidrogeniones
menor pH
Hiperventilando
Disminuye la presión de CO2 y por lo tanto sube el pH
La presión de CO2 es inversamente proporcional al pH.
Cuando sea menor la PCO2 es menor el CO2
menos hidrogeniones
mayor pH
Hipoventilacion
Aumenta la presión de CO2 y baja el pH .
Control renal
Equilibrio ácido - base.
+pH
los riñores no secretan hidrogeniones
por lo tanto disminuirá la absorción de bicarbonatos
-pH
-pH
Riñones secretan mas hidrogeniones
Por lo tanto hay más acidez.
Se secretan hacia la luz tubular y se eliminan
Así disminuye la acidez
+pH
mayor reabsorción de bicarbonatos.
Menor acidez.
+pH
Efecto tardío
pH
El pH es el potencial de Hidrógeniones
Un hidrogenion es aquel hidrógeno que ha perdido su neutrón y solo queda el protón.
pH= -log [H±]
Bases y Ácidos
los ácidos son sustancias que son capaces de dar hidrogeniones
las bases son las sustancias que pueden recibir hidrogeniones.
Escala de pH
La Escala de pH se considera de 1 a 14 donde entre más bajo el ph más ácido y más alto es más alcalino y el 7 se considera punto neutro.
+Ácida = +Hidrogreniones= -pH +Alcalino= -Hidrogeniones= +pH
Constante de equilibrio
En el caso de H2O, en (H+)+ (OH-,) se encuentra que hay dos reacciones, la rotura del H2O para formar (OH-) + (H+) y la otra la formación de H2O a partir de (H+) + (OH-)
Ionización
describe el equilibrio entre las moléculas del ácido que permanecen sin disociarse y los iones formados a partir de dicha molécula.
cuando un ácido débil se disuelve en agua una gran cantidad de las moléculas permanecen en forma neutra, no disociada.
Cuando un ácido fuerte se disuelve en agua la mayor parte de las moléculas se disocian y forman los protones H+
Ka es una constante de equilibrio que mide el grado de disociaciónde un ácido débil en solución.
pKa
Se trata de una medida de acidez, calculada mediante el logaritmo negativo (-log) de la constante de disociación ácida (Ka)
pKa= -log Ka
Arturo Tecocoatzi Cruz 1B